| 9.ヨ−ネ菌による乾酪壊死を伴った山羊の肉芽腫性リンパ節炎 |
| 〔林 正紘(大阪府)〕 |
山羊,雌,約13カ月齢,鑑定殺.山羊・羊繁殖農場でヨーネ病検査を行なった結果,CFとヨーニンで患畜,疑似患畜と判定されたものについて病性鑑定を実施した.提出事例はその中の1頭である.
剖検では,回腸の肥厚と腸間膜リンパ節の著しい腫大がみられたが,それ以外には特に異常はみられなかった.
組織学的には,腸間膜リンパ節の皮膜直下に乾酪壊死巣が多数認められ,その周囲から広範にわたり顕著な類上皮細胞の増殖を特徴とする肉芽腫によって固有構造が置換されていた.壊死巣周囲には多数のラングハンス型多核巨細胞も認められた(図9A).空腸,回腸粘膜においても軽度の好中球,好酸球および単核細胞浸潤を伴った類上皮細胞の増殖が顕著に認められた.肝臓では類上皮細胞の増殖を特徴とした小肉芽腫が散在性に認められた.各病変部におけるチール・ネルゼン染色の結果,リンパ節および空回腸に認められた壊死巣内および多核巨細胞,類上皮細胞細胞質内に,チール・ネルゼン染色陽性の短桿菌が多数認められた(図9B).一方,肝臓で認められた肉芽腫内には抗酸菌は認められなかった.
病原検索では,ヨーニン反応は擬陽性であったが,小腸乳剤のPCR検査とヨーネ菌の培養検査は陽性を示し,CFとエライザ検査は陽性であった.
本例は山羊における,腸間膜リンパ節,肝臓への肉芽組織形成を特徴としたヨーネ病と診断された. |
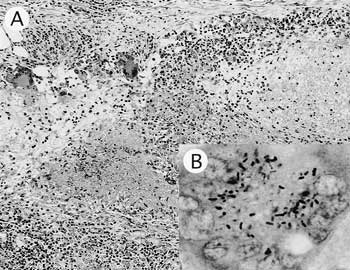
| 図9 |
山羊の腸間膜リンパ節.A:皮膜直下の乾酪壊死巣.類上皮細胞の増殖.ラングハンス型多核巨細胞も認められる(HE染色 ×100).B:多核巨細胞内に認められた抗酸菌染色陽性の短桿菌(チール・ネルゼン染色 ×1,000). |
|
| 10.文鳥のトリコモナス原虫による食道潰瘍 |
| 〔小木曽正和(愛知県)〕 |
文鳥,約4週齡,鑑定殺.文鳥を育成・出荷している飼育者から,一部の文鳥に,食道の開きが悪くなり,餌を十分に摂取できなくなった後,死亡する事例が認められたため,病性鑑定依頼があった.発生率は160羽中8羽および100羽中6羽で,出荷後,返品された文鳥4羽について病性鑑定を実施した.
剖検では,食道粘膜に大豆大の潰瘍が認められた.潰瘍は黄色で堅く,表皮直下にまで達していた.
組織学的には,食道粘膜から筋層,外膜にまで至る広範な潰瘍が認められた(図10A).病巣の中心部は染色性を失った壊死細胞で構成され,壊死巣周囲には浸潤細胞やPAS染色陽性のトリコモナス原虫が層状に認められた.その外層では偽好酸球を主体とした細胞浸潤を伴う変性・壊死が筋層,粘液腺および皮下組織に認められた.潰瘍部以外の食道粘膜表面にもトリコモナス原虫が多数認められ,一部で重層扁平上皮細胞間にもトリコモナス原虫が侵入していた(図10B).病性鑑定を実施した4羽中3羽の食道にトリコモナス原虫が認められ,4羽中2羽で潰瘍形成が認められた.
病原検索では,食道粘膜塗抹材料についてギムザ染色を実施した結果,形態は紡錘形〜楕円形で3本以上の鞭毛(数は不明瞭)と波動膜を有する原虫が4羽中2羽に認められた.形態的特徴および寄生部位(上部消化管)より,今回認められた原虫はトリトリコモナス(Trichomonas
gallinae )と思われた.
以上の成績から,本例を文鳥のトリコモナス感染症と診断した. |
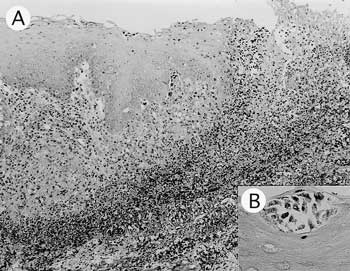
| 図10 |
文鳥の食道.A:健常部との境界部.粘膜から筋層にかけての重度潰瘍(HE染色 ×100).B:健常部粘膜上皮細胞間に認められたトリコモナス原虫(HE染色 ×400). |
|
| 11.ジゼロシンによる鶏の筋胃角質層のびらん |
| 〔松井 望(和歌山県)〕 |
ボリスブラウン,赤玉鶏,雌,120日齢,鑑定殺.採卵鶏約7,500羽飼養の農家で,白玉鶏と赤玉鶏を飼養していて,自家配合飼料に魚粉を10%配合していた.7月にエクアドル産の魚粉に変わった後,8月初旬から元気消失,産卵率の低下,緑色下痢便の排泄等の症状が,2001年4月21日餌付けの大雛導入した赤玉鶏の若鶏に目立って認められた.
剖検では,筋胃の粘膜面の肥厚,粗造化がみられ,びらんや黒色を呈した潰瘍がみられた.十二指腸に針頭大の点状赤色斑が散在していた.そ嚢,腺胃,筋胃内に黒褐色の泥状液が多量に貯留し,菲薄化していた.
組織学的には,筋胃の角質層では角質が疎性化していた(図11).正常ではみられない角質層の水平層紋と垂直層紋が明らかに認められた.角質層紋間隙には剥離した上皮細胞が多数存在し,一部では角質層が剥離していた.筋胃腺では,腺腔内に希薄な分泌物の増量や剥離細胞がみられた.筋層に達する潰瘍や広範囲のびらんを認めた例もあった.腺胃では粘膜上皮細胞の剥離等のカタル性変化を認めた.十二指腸でも粘膜上皮細胞の剥離等のカタル性変化を認めた.
病原検索では,魚粉中のジゼロシン濃度は30.8ppmで,飼料中に20%加えた投与試験で,有色羽毛鶏に同様の病変が再現された.
以上の結果から本症例は,ジゼロシン中毒と診断された. |

| 図11 |
筋胃角質層における角質の疎性化(HE染色 ×25). |
|
| 12.リンパ組織の壊死と著明なマクロファージの浸潤を伴ったニューカッスル病罹患鶏の小腸潰瘍 |
| 〔青柳高弘(長野県)〕 |
イサブラウン種,雌,330日齢,鑑定殺.5,000羽を飼養する採卵農家で2001年6月11日頃より死亡鶏が認められ,15日に当該農家から現地家保に通報があったため立入検査を実施した.一部の鶏群に沈うつ,緑色下痢,翼麻痺および開口呼吸を認めたため重症の3羽を病性鑑定した.6月21日までに240羽が死亡した.鶏群はニューカッスル病(ND)ワクチン未接種であった.
剖検では,気管粘膜の点状出血(1羽),脾臓の褪色および小白色点の多発(2羽),十二指腸潰瘍(1羽),小腸潰瘍(1羽),血腫卵胞および卵墜(2羽)を認めた.
組織学的には,十二指腸および小腸の粘膜固有層リンパ組織の重度の壊死を認め,壊死部およびその周囲には細胞頽廃物を貪食したマクロファージと偽好酸球の浸潤を認めた(図12).また,この部の粘膜浅層は著しい出血および線維素の析出を伴い壊死していた.脾臓は濾胞リンパ球の壊死,脱落および莢組織の変性,壊死が多発し,マクロファージの浸潤が著明であった.肺の二次気管支粘膜固有層,腺胃の浅固有胃腺粘膜固有層および盲腸扁桃の各リンパ組織にも同様の所見が認められた.脳炎は認められなかった.
病原検索では,脾臓および気管の乳剤を接種した発育鶏卵尿膜腔液のHA試験陽性,同材料に対する抗NDウイルス血清を用いたHI試験陽性であった.血清NDHI抗体価は全例4倍以下であった.主要臓器から病原細菌は検出されなかった.
以上の検査結果から本例は典型的なアジア型(内臓型)NDと診断された. |

| 図12 |
小腸粘膜固有層のリンパ組織の壊死,マクロファージ浸潤,粘膜上皮の壊死,出血(HE染色 ×25). |
|
| 13.クマリン中毒豚にみられたうっ血と炎症細胞浸潤を伴う小葉中心性肝細胞変性 |
| 〔小川秀治(秋田県)〕 |
LWD種,雌,80日齢,肥育用,鑑定殺.飼育頭数3,000頭規模の一貫経営農場において,2000年10月中旬頃から生後70日〜90日齢の若齢豚に元気消失,起立不能,前後肢内側部の内出血を主徴とし,斃死する豚がみられた.同様の症状による斃死は10頭みられ,うち3頭の病性鑑定を実施した.
剖検では,前後肢内側部に紫斑がみられ,表層部から深部筋肉にかけて顕著な出血がみられた.肝臓には軽度の褪色がみられた.また,体表リンパ節に血液吸収が認められた.
組織学的に,肝臓ではうっ血と小葉中心性に肝細胞の変性および好中球,好酸球,単核細胞の浸潤がみられた(図13).類洞は拡張し,軽度の好中球の浸潤が認められた.脳では軽度の囲管性細胞浸潤と出血巣がみられた.骨格筋では筋上膜と筋周膜に線維素析出および好中球浸潤を伴う出血がみられ,骨格筋細胞には塊状崩壊や硝子様変性がみられた.変性筋細胞周囲には出血,リンパ球,形質細胞,好中球などの炎症性細胞の浸潤やマクロファージによる貪食,線維芽細胞の増生がみられた.鼠径リンパ節では洞内に血液吸収,好中球浸潤と細網細胞の腫大,小動脈と小静脈に血管壁の水腫が認められた.
病原検索では,病原細菌は分離されず,ウイルス検査では豚コレラFA,オーエスキー病ラッテクス凝集反応は陰性であった.生化学検査では肝臓で1.64ppm,腎臓で0.36ppm,胃内容で0.13ppmと高濃度のクマテトラリル(クマリン)が検出された.
本例は剖検および組織所見に加えて,クマリンが検出されたため,クマリン中毒と診断された.骨格筋の変性はクマリンによる血行障害により生じたものと推察された.原因としては,豚房にしかけられた殺鼠剤(クマリンを含む)の摂取による中毒が示唆された. |
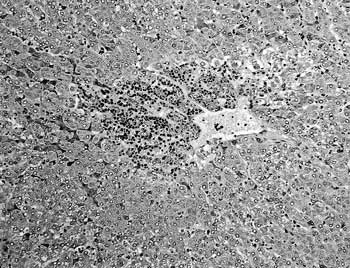
| 図13 |
牛ウイルス性下痢・粘膜病ウイルスによる牛の空腸の陰窩ヘルニアを伴ったパイエル板の萎縮(HE染色 ×50). |
|
| 14.レース鳩の核内封入体形成を伴った肝炎 |
| 〔川鍋真里(福岡県)〕 |
レース用成鳩,性別不明,死亡例(死後約1時間).2001年4月上旬にレースの練習のため放した成鳩が2日後に帰巣してから元気消失・食欲廃絶・衰弱し5月8日死亡した.
剖検では,腹部体腔内に黄褐色ゼリー状の線維素塊と淡黄色腹水の貯溜,膵臓に複数の白黄色結節が認められた.
組織学的には,肝臓では単核細胞・偽好酸球の浸潤を伴う肝細胞の変性,壊死が散在的に認められた(図14A).残存する肝細胞の一部に,核がやや大きく核膜が軽度に濃染し核内にハローをもつ辺縁不明瞭な好酸性核内封入体が散在していた(図14B).小葉間結合 組織に偽好酸球・単核細胞の浸潤が認められた.膵臓では広範囲に巣状壊死が散在し,壊死巣内に血栓が認められ,部分的に単核細胞・多核巨細胞の浸潤を伴っていた.辺縁部の巣状壊死は被膜まで及び,被膜外側に線維素と炎症細胞からなる偽膜が認められた.膵臓構造が残存する領域では小葉間結合組織にリンパ球の巣状浸潤が散在的に認められた.
病原検索では,膵臓,腹水,盲腸内容,主要臓器から細菌は分離されず,肝臓,直腸,気管からウイルスは分離されなかった.肝臓のフォイルゲン反応および抗トリアデノウイルス免疫組織化学染色で核内封入体にDNA反応および陽性抗原を確認できず,電子顕微鏡検索でもウイルス粒子は確認できなかった.
本例は封入体肝炎を疑い病原ウイルスの検索を行ったが確認できず,鳩の封入体肝炎を疑うと診断した. |
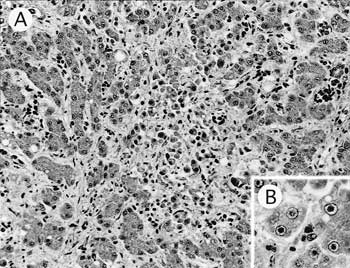
| 図14 |
A:巣状肝細胞変性,壊死(HE染色 ×200);
B:肝細胞の好酸性核内封入体(HE染色 ×400). |
|
| 15.Clostridium chauvoei による牛の出血性心筋炎 |
| 〔小川賀雄(山口県)〕 |
ホルスタイン種,去勢,10カ月齢,死亡例.肥育牛140頭を飼養する農場において,2001年6月8日に1頭,6月12日に2頭の計3頭が死亡したため,6月12日に病性鑑定依頼があった.提出事例は,6月12日に死亡した1頭で,前日より元気消失,食欲不振,歩様蹌踉,発熱(40℃),腰部および臀部の気腫などの症状を示したため,診療獣医師により,解熱剤および抗生物質の投与が行われていた.
剖検では,左胸部,腰部および臀部の皮下気腫,胸部筋肉の出血,気腫が認められた.胸腔内には血液を混じた胸水が多量に貯留していた.肺,心臓,横隔膜には出血がみられ,肝臓,脾臓では軽度な腫大がみられた.
組織学的には,心臓の小静脈および毛細血管のうっ血,出血が顕著に認められ,心筋間質への出血および好中球を主体とした細胞浸潤(図15),心筋の変性,心外膜面における線維素滲出が認められた.肝臓では小葉中心壊死,腎臓では軽度なうっ血,脾臓では濾胞リンパ球の減少が認められた.肺では軽度なうっ血,肺胞内や小葉間に漿液滲出,骨格筋では,間質に大小の空胞,出血,筋線維の変性が認められた.
病原検査では,心臓(心筋)よりClostridium chauvoei が分離された.
以上の所見から,本症例は気腫疽と診断された. |

| 図15 |
心筋間質における出血と好中球浸潤(HE染色 ×100). |
|
| 16.Haemophilus somnus による牛の心臓の多発性微小膿瘍と化膿性髄膜小脳炎 |
| 〔茨木義弘(広島県)〕 |
ホルスタイン種,雄,3.5カ月齢,肉用,鑑定殺.約250頭を飼養する哺育育成農家で,2000年7月に県内家畜市場から約2週齢で導入した子牛が,9月上旬に発咳を呈し治療後に回復した.しかし,10月中旬,突然起立不能となり,同日鑑定殺を行った.
剖検では,心臓の左心室心外膜面に直径約8cmの赤色部を認め,割面も広範囲に暗赤色化していた.また,混濁心嚢水が約200ml貯留していた.肺では左右前葉,中葉下半部に肝変化が認められた.
組織学的には,心臓では血管炎,血栓形成,グラム陰性短桿菌による菌塞栓および出血を伴った微小膿瘍が多発していた(図16A).同部位の抗Haemophilus somnus ウサギ血清(動物衛生研究所)を用いたSAB染色で,これらの菌塊は陽性であった.中枢神経系では,おもに小脳皮質分子層に微小膿瘍および出血が散見され(図16B),髄膜では線維素析出を伴った化膿性髄膜炎が認められた.肺では化膿性気管支肺炎,線維素性胸膜炎が認められた.
病原検索では,H. somnus が心臓から>103cfu/ml,脳,脊髄,肝臓,脾臓および腎臓から101cfu/ml分離された.同菌はグループ1,抗原型1型と同定された.その他,腎臓からSalmonella
Dublin が分離された.
今回の症例はH. somnus 感染症と診断された.本例では心臓に重度な病変を形成していたが,中枢神経系の病変は軽度であった.これらの病変分布は従来報告されてきたH. somnus 感染症とは異なっていたが,病変分布の違いに関与した要因は不明であった. |
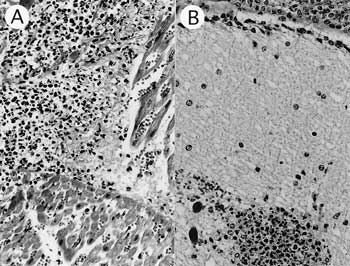
| 図16 |
A:心筋の微小膿瘍(HE染色 ×200);B:小脳の微小膿瘍と化膿性髄膜炎(HE染色 ×200). |
|
|