| 17.牛の心筋における高度のサルコシスト寄生 |
| 〔平澤康伸(滋賀県)〕 |
黒毛和種,雌,約1年6カ月齢,死亡例(死後約5時間).飼養規模約150頭の肥育農家で,他県より導入した雌7頭の群に2001年2月初旬に食欲不振を主とする臨床症状が認められた.共済獣医師が加療したが症状改善せず衰弱し,3月5日から5月4日にかけて雌の群の6頭を病性鑑定した.提出症例は5月3日に起立不能に陥り未明に死亡,4日に病性鑑定を行った.
外貌は,削痩,眼球陥没し,泡沫鼻汁が少量漏出していた.剖検では,肺が前葉から中葉にかけて肝変化し,割面に微小膿瘍が散見された.気管支腔内に中等度の泡沫内容を容れていた.舌および軟口蓋に米粒大の糜爛,潰瘍が散見された.
組織学的には,心筋に成熟過程にあるサルコシストの高度寄生を認め(図17),筋間結合織に中等度のリンパ球浸潤を認めた.食道の筋層,横隔膜,舌および骨格筋にも未熟から成熟過程にあるサルコシスト寄生を認めた.肺では中等度の膿瘍形成が多発し,肺胞腔に好中球浸潤,線維素析出等を認めた.大脳では瀰漫性に軽度の囲管性単核細胞浸潤を認めた.舌表面に菌の付着を伴う潰瘍を認め,軟口蓋に糜爛を認めた.心筋に寄生していたサルコシストの電子顕微鏡観察では,Sarcocystis
cruzi に特徴的なシスト壁を持っていた.
細菌検査で肺からPasteurella multocida,P. haemo-lytica,Haemophils somnus およびE. coli を,その他の主要臓器からE.
coli を分離した.
住肉胞子虫の高度感染,発症時期等から,本例は住肉胞子虫症と診断され,肺炎等は2次的な症状と思われた. |
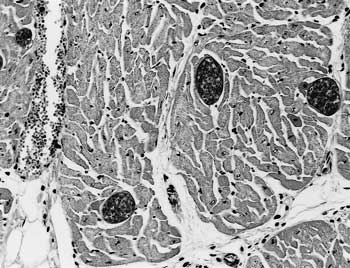
| 図17 |
心筋におけるサルコシストの高度寄生(HE染色 ×200). |
|
| 18.牛の心筋間質の線維化 |
| 〔市沢三香(千葉県)〕 |
ホルスタイン種,雌,33カ月齢,死亡例(死後約3時間).粕類を多給していた乳肉複合経営農家(乳用30・育成20・肉用10頭)で,2000年7月4日,自家産・自家育成の搾乳牛(1産)が発熱・食欲不振を呈し,2日間にわたり抗生物質などにより治療したが,7月6日突然転倒し死亡したため病性鑑定を実施した.
剖検では,心外膜に米粒大出血斑および褪色が認められ,腎臓に両側性の腫大と多発性小膿瘍が認められた.
組織学的には,心臓では心筋の軽度の萎縮および線維化が巣状に認められ(図18),アザン染色では心筋間質に濃青色に染まる膠原線維が著明であった.肺では両側性にうっ血性肺水腫が認められた.腎臓では皮質から髄質に及ぶ多発性膿瘍の形成が認められたが,グラム染色では膿瘍内に菌体の存在は確認されなかった.他の諸臓器に著変は認められなかった.
細菌検査で,肺および腎臓から大腸菌が分離された.小腸上部および中部からClostridium perfringens が104cfu/g以上分離されたため,毒素試験として小腸上部および中部の消化管内容ならびに分離菌の培養上清を,マウスの尾静脈内に接種して48時間観察したがマウスはすべて生存した.死亡前に採血した血液検査では,生化学的に異常値は認められず,血中硝酸態窒素は0.16μg/ml であった.
発生農場では,数年来成牛の突然死が多発していたが,原因の特定には至っておらず,粕類の給与量を減らすなどの試みにより死亡牛は認められなくなった.本症例からは,成牛の心不全による死亡が疑われた. |
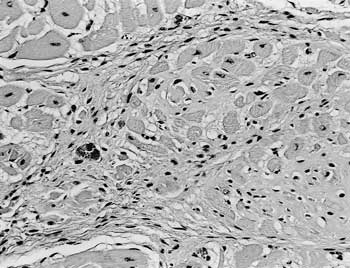
| 図18 |
心筋の軽度の萎縮および線維化(HE染色 ×200). |
|
| 19.Salmonella O9群抗原を認めた鶏の心外膜炎および心筋炎 |
| 〔高橋幸治(宮城県)〕 |
コブ種,雄,60日齢,放血殺.22,500羽を飼養するブロイラー農家で,2001年1月27日に入雛した群の発育にばらつきが大きくなり,死廃が多いため(異常羽数1,000羽,死亡500羽)病性鑑定を実施した.ワクチンは種鶏場でIB,14・21日齢でND・IBDを接種していた.本症例では,元気消失や歩様困難,羽毛逆立,発育遅延(体重1.8kg)などを認めた.
剖検では,腹水が貯留し,肝臓は褪色し,表面には広範囲に針頭大の点状出血と白斑を認めた.筋胃の噴門側に血腫(1.5×1cm),幽門側に潰瘍(1.5×1cm)を認めた.空腸上部では粘膜に点状出血を認め,左右足根間関節部には黄色の混濁した関節液が貯留していた.
組織学的には,心臓の壊死巣(図19)および心外膜にリンパ球とマクロファージを主体とした少数の偽好酸球を含む細胞浸潤が認められた.肝臓のグリソン鞘および腎臓の尿細管周囲間質に偽好酸球やリンパ球などの浸潤を認めた.その他,カタル性気管支肺炎,潰瘍を伴う化膿性筋胃炎,カタル性小腸炎および盲腸・結腸炎,化膿性漿膜炎,肉芽腫性脾炎を認めた.
病原検索では,ウイルス分離陰性,ウイルス抗体検査でニューカッスル病抗体40倍であった.細菌培養により,肝,脾,腎,心,精巣からSalmonella Pullorum が分離された.抗サルモネラO9群血清(デンカ生研)を用いた免疫組織化学染色により心外膜および筋線維間の細胞集簇巣や尿細管周囲細胞集簇巣,肝・脾・肺に陽性抗原を認めた.
以上の結果から,本症例は鶏サルモネラ症(ひな白痢)と診断された. |
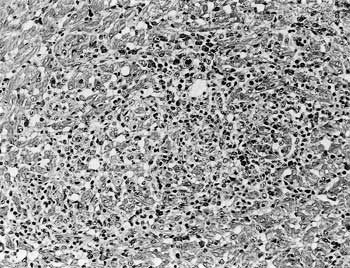
| 図19 |
心筋の壊死およびリンパ球やマクロファージの浸潤(HE染色 ×200). |
|
| 20.牛の頸静脈の血栓症 |
| 〔本多秀次(富山県)〕 |
牛(交雑種),去勢,4カ月齢,死亡例.2000年10月29日生まれの子牛で,翌年1月下旬に畜主が頸部の腫脹を発見した.死亡する前の週に異常に汗をかいているのを畜主が観察しており,2月20日に診療獣医師がオキシテトラサイクリンの静注による治療を行ったが,翌朝,畜主が当該牛の死亡を発見した.
剖検では,左側頸静脈上部に鶏卵大の腫瘤が形成され,切開すると血管内に長さ約5cmの塞栓があり,剥離が困難であった.右側の頸静脈は全体に著しく怒張していた.肝臓は著しく腫大し,割面は黄色を帯びていた.心臓は腫大し,心膜の表面は水腫状であった.肺は大部分が肝変化し,割面から膿汁の漏出がみられた.
組織学的には,頸静脈内膜上にフィブリンの沈着層が形成されていた(図20A).内・中・外膜は水腫性に疎性化し,変性白血球の滲出がみられた.外膜周囲の疎性結合組織の線維間にエオジン好性の同心円状の結晶様物が多数みられた(図20B).この物質は,PTAH染色で青藍色に染色される部位と染色されない部位がみられた.その他の臓器では,肝細胞の空胞化が顕著にみられた.肺では,細気管支から肺胞腔内に好中球の浸潤およびフィブリンの析出がみられ,一部の小血管では管腔内に充満するフィブリン集塊がみられた.
病原検索では,主要臓器から病原細菌は分離されなかった.
頸静脈外膜周囲にみられた同心円状の結晶様物は,血漿成分が血管壁外に漏出して形成されたもので,経過によってPTAHの染色性が異なったものと推察された. |
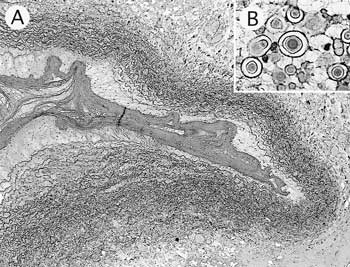
| 図20 |
牛の頸静脈の血栓形成.A:頸静脈内腔に形成されたフィブリンの沈着層(HE染色 ×25);B:頸静脈周囲組織に形成された同心円状の結晶様物(HE染色 ×400). |
|
| 21.牛RSウイルスによる好酸性細胞質内封入体を認めた合胞体形成性気管支肺炎 |
| 〔宮野英喜(福島県)〕 |
黒毛和種,去勢,約10カ月齢,死亡例(死後約17時間).2001年2月8日に競り市場より購入した牛が,2月15日に泡沫性流涎や呼気性呼吸困難等を呈した.前頸部皮下には鶏卵大腫瘤が存在した.このため牛は急性咽喉頭炎を疑われ,加療されたが,同日夕刻死亡し,翌日剖検された.
剖検では,肺で多発性巣状出血,辺縁の肝変化および間質性気腫が認められた.前頸部皮下腫瘤は脂肪腫様であった.
組織学的には,肺で著しい血液充盈と間質性気腫が認められ,細気管支および肺胞腔内には中等度の好中球およびマクロファージの浸潤が観察された.細気管支粘膜および肺胞壁では多核巨細胞の形成がみられ(図21A),多核巨細胞および気管支粘膜上皮細胞の細胞質内に好酸性封入体が多数認められた(図21B).抗ヒトRSウイルスF蛋白質マウスモノクローナル抗体(ARGENE,18B2)を用いたSAB法では,多核巨細胞や気管支粘膜上皮細胞に陽性反応が観察された.陽性反応は細胞質内よりも管腔に面した細胞膜上で特に明瞭であった.電子顕微鏡観察では気管支粘膜上皮細胞細胞質内にヌクレオカプシドの集塊が観察された.前頸部の皮下腫瘤は脂肪腫であった.
主要臓器と脳から細菌は分離されなかった.RS-EIA法により気管支粘膜および肺乳剤からRSウイルス抗原が検出された.
典型的な肺病変が観察されたため,牛 RSウイルス病と診断された. |
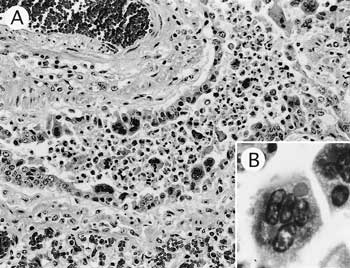
| 図21 |
A:細気管支粘膜における多核巨細胞の形成(HE染色 ×200);B:多核巨細胞細胞質内の好酸性封入体(HE染色 ×1,000). |
|
| 22.豚における気管支周囲リンパ装置の過形成を伴うカタル性気管支肺炎 |
| 〔高橋周子(動物検疫所)〕 |
デュロック種,雄,8カ月齢,自衛殺例.2000年10月に輸入検疫を実施した米国産繁殖用豚33頭のうち,9頭に発熱および発咳などの呼吸器症状が認められた.無症状豚のうちの1頭が豚繁殖・呼吸障害症候群(PRRS)のELISA陽性豚として摘発され,自衛殺処分されたので,病理および病原学的検査を実施した.
剖検では,肺の左右前葉および中葉の辺縁部に,健康部との限界明瞭な赤色の病変が認められた.
組織学的には,肺の気管支および血管周囲に著しいリンパ装置の過形成が観察された(図22).肺胞壁ではII 型肺胞上皮細胞の増数が観察された.肺胞腔内にはマクロファージ,形質細胞およびリンパ球が軽度から中等度に浸潤していた.透過型電子顕微鏡検査により,細気管支粘膜上皮細胞の線毛にマイコプラズマが多数付着しているのが確認された.Mycoplasma
hyopneumoniae, M. hyorhinis およびPRRSウイルスに対する抗血清(動物衛生研究所)を用いた免疫組織化学的検査(SAB法)の結果は陰性であった.
血清学的に,CF試験によるM. hyopneumoniae 抗体は8倍であった.PRRSについては,間接蛍光抗体法による血清抗体検査,血清および臓器からのウイルス分離,RT-PCR法によるウイルス核酸検出のいずれも陰性であった.
以上の検査成績から,本例は豚マイコプラズマ肺炎と診断された.なお,提出標本では肺胞腔内への細胞浸潤や肺胞壁におけるII 型肺胞上皮細胞の増数は軽微であった. |
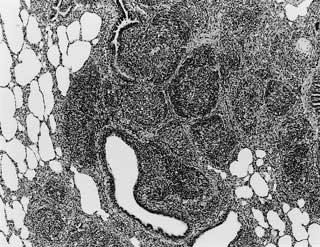
| 図22 |
気管支周囲における著しいリンパ装置の過形成(HE ×40). |
|
| 23.豚回虫症における豚の好酸球性間質性肺炎 |
| 〔中村 博(東京都)〕 |
LWD種,去勢,月齢不明,体重66kg,死亡例(死後約半日).肥育豚30頭を飼養する農家で,子豚市場から導入後1カ月の豚1頭が死亡した.豚は導入後死亡前日まで特に異常は示さず発育良好であったが,死亡前日の夕刻食欲が低下し,夜に起立不能,呼吸が浅速となり,翌朝死亡して発見された.
剖検では,鼻孔から粘液を混じた血液が漏出していた.肺は退縮不全を呈し,表面は平滑となっていた.気管粘膜は充血していた.肝臓は褪色し,白斑が多発していた.消化管は小腸から結腸にかけて赤色調で,赤色液状の内容物を入れていた.
組織学的には,肺胞壁,細気管支周囲および小葉間結合組織には,巣状あるいはび漫性の重度の好酸球浸潤が観察された(図23).肺胞内には線虫の断面がごくまれに認められた.肺胞内の巣状出血が散発性に観察された.肝臓ではうっ血がみられ,小葉間結合組織では好酸球が中等度から重度に浸潤していた.消化管粘膜は自己融解していた.
病原検索では,腸内容物からEscherichia coli が分離され,PCR法でVT2遺伝子のバンドが検出された.同居豚の糞便検査で6頭中5頭に回虫卵がみられた.
本症例は,豚回虫症と診断された.肺と肝臓を中心に観察された重度の好酸球浸潤は,回虫由来の好酸球走化因子(ECF-P)および肥満細胞由来の好酸球走化因子(ECF)に対する反応と考えられた.
|
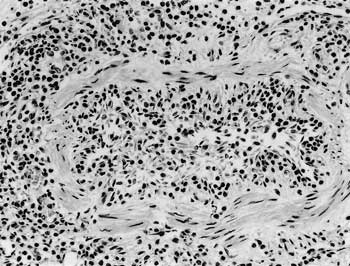
| 図23 |
細気管支粘膜固有層および粘膜下組織における重度の好酸球浸潤(HE ×200). |
|
| * 独立行政法人農業技術研究機構動物衛生研究所(〒305-0856 つくば市観音台3-1-5) |
| * National Institute of Animal Health (3-1-5 Kannondai, Tsukuba,
Ibaraki 305-0856) |
| † 連絡責任者: |
谷村信彦(独立行政法人農業技術研究機構動物衛生研究所 感染病研究部感染病理研究室)
〒305-0856 つくば市観音台3-1-5
TEL: 0298-38-7837
FAX: 0298-38-7838 |
| † Correspondence to : |
Nobuhiko TANIMURA (National Institute of Animal Health)
3-1-5 Kannondai, Tsukuba, Ibaraki 305-0856, Japan
TEL: 0298-38-7837
FAX: 0298-38-7838 |
|