2001年度の家畜衛生研修会(病性鑑定病理部門)が農林水産省生産局衛生課の主催により,2001年11月13日から16日にかけて動物衛生研究所で開催された.今回の提出演題は46題で,45都道府県および農林水産省動物検疫所から提出された.
以下に今回の提出事例を述べる.
| 1.Clostridium chauvoei による重度の気腫を伴う牛の出血性壊死性舌炎 |
| 〔飯塚綾子(栃木県)〕 |
牛(交雑種),性別不明,4カ月齢,死亡例(死後約2時間).肥育牛約140頭を飼養する農家で,1999年5月中旬生まれの子牛1頭が,8月26日に鼻汁排泄,27日に下顎部に限局する腫脹を呈し死亡した.
剖検では,舌がスポンジ状に肥厚し,約10cmの裂傷が認められた.下顎部皮下組織に暗赤色の膠様浸潤があり,耳下および下顎リンパ節は腫大していた.心臓は心外膜に線維素が付着し,心室壁は肥厚していた.
組織学的には,舌粘膜の潰瘍,粘膜固有層および筋層の結合組織に重度の出血,水腫,気腫形成,好中球浸潤および多数のグラム陽性有芽胞大桿菌(図1B)を認めた.舌の筋線維は輪郭を保ちながらも多発性に壊死に陥り粗造化・融解していた(図1A).下顎部皮下組織ではび漫性の水腫と好中球浸潤,心臓では重度の線維素析出を伴う化膿性心外膜炎,下顎リンパ節では多発性の気腫形成と化膿性リンパ節炎を認めた.抗気腫疽菌ウサギ血清(動物衛生研究所)を用いた免疫組織化学的染色(SAB法)により,舌,下顎部皮膚,心臓,下顎リンパ節,肺,大脳で気腫疽菌特異抗原が検出された.
病原検索では,肝臓からClostridium chauvoei が分離され,PCR法により舌筋,肝臓,血液から気腫疽菌特異遺伝子断片が検出された.
本例は病原検索および病理学的所見から,気腫疽と診断された. |
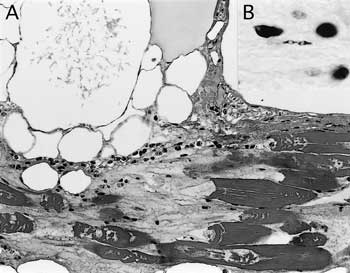
| 図1 |
A:舌横紋筋の断裂・融解,間質の気腫,水腫,出血(HE染色 ×200);B:横紋筋周囲のグラム陽性有芽胞大桿菌(グラム染色 ×1,000). |
|
| 2.牛の第二胃気腫 |
| 〔岡 あかね(京都府)〕 |
黒毛和種,去勢,13カ月齢,死亡例.2001年4月,肥育牛250頭を飼養する農家で去勢牛1頭が発熱,呼吸速拍,鼻汁流出のため受診した.補液および抗生剤で加療したが,3日後に飲水の逆流および高度の脱水状態を認め,4日後死亡したため病性鑑定を実施した.イバラキ病ワクチンは未接種であった.
剖検では,胃内容物の乾燥,第二胃壁の軽度脆弱化および粘膜下織の多数の空隙,第四胃から回腸の菲薄化と粘膜の充血・出血,心外膜の出血,気管内の泡沫様物を認めた.
組織学的には,第二胃の粘膜下織の広範囲に多数の直径約0.1〜0.5mmの嚢胞状空隙が存在し,嚢胞周囲には膠原線維の増生,軽度のリンパ球浸潤,マクロファージおよび多核巨細胞の集簇が認められた(図2).嚢胞の一部は,マクロファージと思われる細胞で内張されていた.第二胃切片のグラム染色およびチールネルゼン染色で,細菌は検出されなかった.消化管粘膜,肝臓,腎臓および中枢神経系組織の毛細血管と小静脈のうっ血が認められた.舌,食道および咬筋には著変がなかった.
病原検索では,イバラキ病の中和抗体価は<×2,洗浄赤血球を用いたRT-PCRでイバラキ病ウイルス核酸は陰性,ゲル内沈降反応でブルータングウイルス抗体は陰性であり,両ウイルスの関与は血清学的に否定された.
本例は牛の第二胃気腫と診断された.臨床上みられた嚥下困難および脱水と第二胃気腫との関連性は少ないと考えられた. |
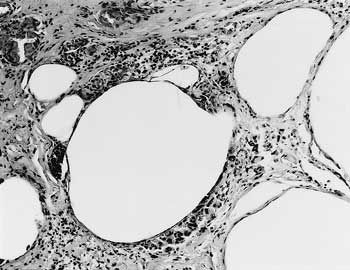
| 図2 |
粘膜下組織に多発性嚢胞形成,嚢胞周囲に線維増生,リンパ球・多核巨細胞の集簇が認められる(HE染色 ×100). |
|
| 3.牛の接合菌性第三胃炎 |
| 〔赤沼 保(青森県)〕 |
黒毛和種,雄,40日齢,死亡例(死後約2時間).2001年5月17日,繁殖雌牛5頭,育成牛3頭,子牛4頭を飼養する農場で子牛1頭に血便が認められた.寄生虫検査の結果コクシジウム症と診断され,サルファ剤を中心とした治療が続けられたが,元気消失,脱水および肺雑音等の症状が目立ち始め,5月31日に死亡した.
剖検では,第三胃漿膜面の一部が不潔暗赤色化し,粘膜面は暗赤色を呈していた.第四胃では幽門部粘膜に暗赤色潰瘍が認められた.肺表面には粟粒大灰赤色結節が散在し,右肺中葉は肝変化していた.胸腺は中等度に萎縮していた.
組織学的には,第三胃では粘膜上皮・固有層から粘膜下組織,筋層,漿膜にかけて多数の真菌菌糸が認められ,重度の好中球浸潤と出血を伴っていた(図3A).菌糸の一部は血管壁や血管内腔に侵入し,線維素血栓や壊死性血管炎を伴っていた(図3B).菌糸は幅広く隔壁はまれでよじれがあり不規則に分岐していた.同様の病変は第一胃と第四胃でも観察された.結腸ではびらんおよび潰瘍性結腸炎,肺では気管支内の壊死性滲出物中にアスペルギルス様真菌の増殖を伴う真菌性化膿性肺炎が認められた.胸腺では皮質リンパ球が脱落し皮髄境界は不明瞭であった.
病原検索では,主要臓器から病原細菌は分離されなかった.糞便からロタウイルスおよびアデノウイルス抗原は検出されなかった.
以上の所見から本例では結腸炎による衰弱等が接合菌感染の素因となったと推察され,子牛の真菌性胃炎と診断された. |
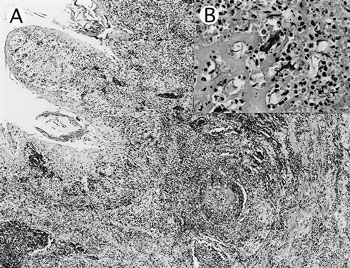
| 図3 |
A:粘膜上皮から筋層に及ぶ化膿性壊死性炎(HE ×50);B:小静脈血栓内に侵入・増殖する接合菌(HE染色 ×200). |
|
| 4.クリプトスポリジウムおよびロタウイルス感染牛の空腸にみられた絨毛の萎縮 |
| 〔有田章一(宮崎県)〕 |
黒毛和種,雄,13日齢,死亡例(死後4時間).繁殖和牛47頭飼育の生産農家で2000年12月,分娩直後から子牛の水様性下痢が多発し,6頭が衰弱死した.当該牛は,2日齢から下痢を始め,その後水様性下痢が激しく,13日齢で死亡した.
剖検では,第一胃から第四胃粘膜に出血が認められ,漿膜面に及んでいた.空腸から結腸まで粘膜に充・出血が認められ,特に空腸では壁の菲薄化および水腫が顕著であった.腸間膜の水腫および腸間膜リンパ節の腫大が認められた.
組織学的に,空腸では絨毛の萎縮および上皮細胞の立方化・扁平化が認められ(図4A),絨毛頂上部の上皮細胞は空胞化し,さらに絨毛表層から陰窩にかけて上皮の刷子縁に多数のクリプトスポリジウム寄生が認められた(図4B).粘膜固有層から下組織,漿膜に顕著な水腫が認められた.クリプトスポリジウム寄生は回腸と結腸にも認められた.第一胃から第四胃ではカンジダ様真菌と接合菌による重度の胃炎が認められた.免疫組織化学的に,空腸の萎縮絨毛上皮細胞の細胞質内にロタウイルス抗原が検出された(バイオスタット社,抗Rotavirus
all antigens血清).
病原検索では,空腸内容物からロタウイルス抗原(ロタテストパック)が検出された.腸内容物から分離された大腸菌は毒素産生陰性で,主要臓器からは病原細菌は分離されなかった.
本例は,ロタウイルスとクリプトスポリジウムの複合感染により激しい水溶性下痢を呈し,真菌性胃炎を伴って重篤な経過をたどり死亡したものと推察された. |
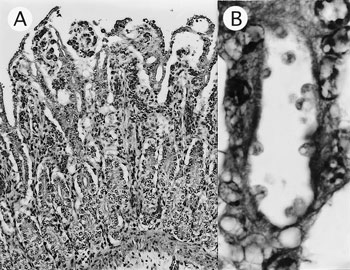
| 図4 |
A:絨毛の萎縮(HE染色 ×100);B:粘膜上皮細胞表層に寄生するクリプトスポリジウム(HE染色 ×1,000). |
|
| 5.牛ウイルス性下痢・粘膜病ウイルス感染牛にみられた空腸の陰窩ヘルニアを伴ったパイエル板の萎縮 |
| 〔樋口明宏(群馬県)〕 |
ホルスタイン種,雄,102日齢,鑑定殺.搾乳牛約190頭を飼養する酪農家で,2001年2月7日生まれの子牛が生後5日目から下痢または血便を繰り返し,数回の治療を行ったが予後不良と判断され,5月30日に鑑定殺された.母牛は自家産の3産目で3種混合ワクチン等の接種歴はなかった.
剖検では,頸部および胸部胸腺は重度に萎縮し,全身リンパ節は水腫性であった.第一胃から直腸まで消化管は弛緩し,腸管内容は水溶性であった.肺は小葉単位に暗赤色部が点在していた.
組織学的に,空腸の一部の陰窩は内腔に剥離上皮細胞,好中球および粘液が充満して著しく拡張し,粘膜下組織に嚢胞状に突出していた(陰窩ヘルニアHerniation of crypts).粘膜下組織のパイエル板は重度に萎縮し(図5),一部のリンパ濾胞内に嚢胞が形成されていた.絨毛の軽度萎縮,表層上皮の扁平化および固有層の水腫が認められた.回腸ではパイエル板の重度萎縮,盲腸と直腸では軽度〜中程度の化膿性陰窩炎が認められた.肺では一部の気管支・細気管支腔内にアスペルギルスの増殖を伴う細胞退廃物が充満し,小葉単位に無気肺がみられた.
病原検索では,主要臓器,筋肉,空腸,リンパ節および血液からCPE(−),I a型の牛ウイルス性下痢・粘膜病ウイルス(BVD-MDV)が分離された.本牛および母牛の抗BVD-MDV中和抗体価はそれぞれ<2,128倍であった.
以上の所見から本例は牛ウイルス性下痢・粘膜病と診断された. |
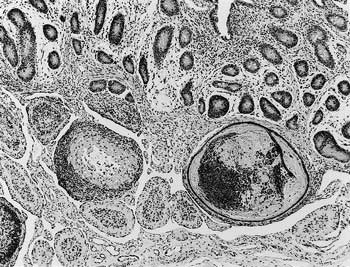
| 図5 |
牛ウイルス性下痢・粘膜病ウイルスによる牛の空腸の陰窩ヘルニアを伴ったパイエル板の萎縮(HE染色 ×50). |
|
| 6.豚のサーコウイルス性封入体形成とリンパ球減少を特徴とするリンパ節炎 |
| 〔佐々木真也(岡山県)〕 |
バークシャー種,雌,約3カ月齢,死亡例(死後約24時間).肥育豚3,000頭を飼養する一貫経営農場で,2001年1月中旬の立入検査で肥育豚3頭,離乳豚2頭が死亡していた.本例はそのうちの1頭で,やや削痩していた.同農場では定期的にPRRS,AD抗体の検査を実施しているが,いずれも陰性であった.呼吸器病対策として,AR,マイコプラズマおよびヘモフィルスワクチンを使用しているが,肥育豚の死亡例では胸膜肺炎と診断されることが多く,死亡率はさほど低下していない.
剖検では,全身のリンパ節は赤色を呈し,2〜3倍大に腫大していた.肺ではほぼ全葉にわたるうっ血と硬化に加え,後葉の胸膜への癒着と前葉の多発性粟粒大膿瘍を認めた.
組織学的には,全身のリンパ節,特に回腸パイエル板および腸間膜リンパ節において,リンパ球の減少と単核食細胞系細胞の浸潤が顕著に認められた.浸潤した単核食細胞系細胞の多くに,好塩基性ブドウ房状細胞質内封入体が多数認められた(図6).肺病巣は凝固壊死巣および膿瘍を多数伴った化膿性気管支肺炎を呈していた.肝臓では血管のフィブリノイド壊死とともに肝細胞の巣状壊死が顕著に認められ,脾臓では濾胞リンパ球の減少と血管周囲炎とともに好塩基性ブドウ房状細胞質内封入体が顕著に認められた.
本例は,全身のリンパ・造血組織でのリンパ球減少,好塩基性ブドウ房状細胞質内封入体形成および肝臓をはじめとする諸臓器における病変形成が認められたことから,離乳後多臓器性発育不良症候群(PMWS)と診断された.呼吸器病による死亡率増加には,サーコウイルス感染症による免疫低下が関与していると考えられた. |
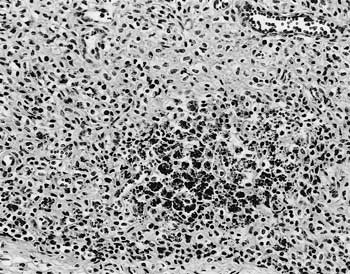
| 図6 |
豚の腸間膜リンパ節.顕著なリンパ球の枯渇と好塩基性ブドウ房状細胞質内封入体形成(HE染色 ×200). |
|
| 7.豚赤痢菌および大腸バランチジウムによる豚の壊死性大腸炎 |
| 〔青野逸志(愛媛県)〕 |
LWD種,去勢雄,61日齢,死亡例(死後約3時間).2000年11月に母豚50頭の一貫経営農場で,育成舎に移動した子豚が黒色水様性下痢を呈して徐々に削痩し,20頭中13頭が死亡した.検体はこの内の1頭で極度に削痩していた.
剖検では,結腸および盲腸粘膜に白色の偽膜様物が付着し,肺は一部肝変化していた.
組織学的には,結腸および盲腸の粘膜表層が広範に壊死し多量の粘液が貯留していた.多くの陰窩は貯留粘液により拡張し,杯細胞の過形成が認められた.粘膜固有層では血栓形成も認められた.粘膜表層の壊死部や陰窩内では大腸バランチジウムが認められ,固有層や粘膜下組織にも侵入していた(図7).Warthin-Starry
染色では,粘膜壊死部と陰窩の粘液内に多数のラセン状長桿菌を認めた.また,陰窩内にトリコモナス様原虫を認めたが,細胞反応は認められなかった.肺では,肺胞および気管支腔内に多数の好中球,マクロファージが浸潤し一部壊死も認められた.
病原検索では,直腸便からBrachyspira hyodysenteriae,肺からはBarcanobacterium pyogenes が分離された.
大腸バランチジウムは通常,健全な粘膜中には侵入せずに宿主と共生状態にあるが,豚赤痢菌等の感染下において腸粘膜に侵入し広範な壊死等の病変を形成することがある.以上の結果から,本例は豚赤痢菌と大腸バランチジウムの混合感染症と診断された. |
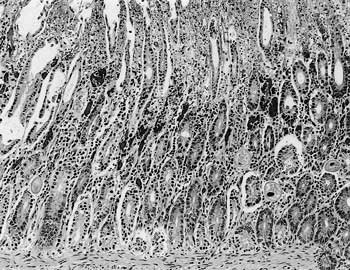
| 図7 |
豚の結腸.粘膜表層の広範な壊死と粘膜固有層に侵入した大腸バランチジウム(HE染色 ×100) |
|
| 8.クロカンガルー(western gray kangaroo)の小腸にみられたコクシジウム寄生による出血性壊死性腸炎 |
| 〔塩谷治彦(静岡県)〕 |
クロカンガルー,雄,2歳3カ月齢,死亡例.クロカンガルーの飼養総数6頭の動物園で,全頭が突然血便や食欲不振を示し,その日の内に3頭が死亡した.残りの3頭には抗生物質投与等の治療をしたが,内2頭は1週間以内に死亡した.最初に死亡した1頭は発症の約2カ月前にアメリカから導入しており,また隣接舎には約1カ月前にニュージーランドから導入したワラビーが飼育されていた.ワラビーからはコクシジウムオーシストが検出されていた.
剖検では,第一胃から大腸にかけての粘膜面に出血がみられ,特に小腸の出血は顕著であった.
組織学的に,小腸では粘膜表層から腸陰窩にかけて広域にわたり顕著な充・出血が認められた(図8A).粘膜組織構造はほとんど消失し,コクシジウムの第1代シゾントおよび第2代シゾントとそれを取り巻く結合組織に置換されていた(図8B).わずかに残存した腸腺部分において,上皮細胞内への第1代シゾントの寄生が認められた.腸絨毛先端部では粘膜上皮の壊死と形質細胞を主体とした顕著な細胞浸潤が認められた.また結腸においても粘膜上皮の壊死が認められた.腎臓では顕著な石灰沈着が認められた.肺では肺胞壁の充血が顕著であった.
カンガルーではコクシジウムの感染は珍しくなく,通常不顕性に認められる.しかし,時に大型のカンガルーにおいて重篤な病変を引き起こし突然死にいたることもある.本症例は急性例であるためか,糞便および腸内容よりオーシストは検出できず,種の同定には至らなかった. |
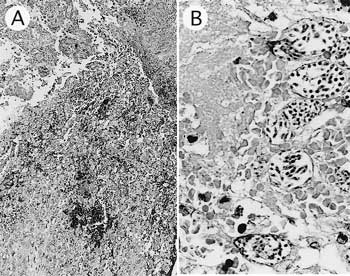
| 図8 |
クロカンガルーの小腸.A:粘膜表層の重度の充・出血.粘膜組織は寄生コクシジウムによってほぼ置換されている(HE染色 ×50).B:粘膜固有層に認められた第2代シゾント(HE染色 ×400). |
|
|







