![]()
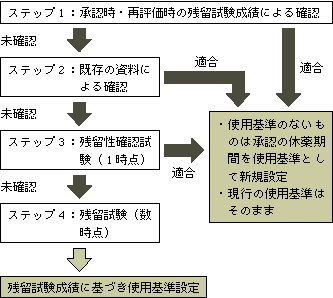
| 3 薬事法の規制とポジティブリスト制度への対応 ポジティブリスト制度に対応するために,農林水産省は,「投与後,定められた休薬期間経過後に生産される畜水産物が食品衛生法による規制に適合する.」よう対策を行っている.つまり,農林水産大臣が製造販売承認している動物用医薬品について,薬事法の規定に基づいて動物用医薬品の使用の規制に関する農林水産省令(昭和55年農林水産省令第42号)により定めている使用基準及び個々の動物用医薬品について承認している休薬期間をポジティブリスト制度に適合するように改正または変更し,食品衛生法による新しい規格基準に適合する畜水産物が生産されるよう規制していくこととしている.なお,使用基準を設ける医薬品においては「使用禁止期間」,使用基準のない医薬品の承認においては「休薬期間」という表現をしているが,意味するところは同じで,食用に供するためにと殺,搾乳,採卵,はちみつ等の採取をする前に医薬品を投与してはならない期間である. 具体的には,現在製造販売承認されている動物用医薬品の使用基準及び休薬期間が食品衛生法の新しい規格基準に適合しているかどうかについて,これらの承認申請の際の対象動物を用いた残留試験資料,再評価の際の残留試験に関する資料を用いて確認する(ステップ1),学術文献等を用いて確認する(ステップ2),農林水産省が新たに残留試験を実施して確認する(ステップ3,承認された休薬期間経過後の1時点で採材し分析する試験)及びさらに残留試験を実施して新しい使用基準または休薬期間を設定する(ステップ4,医薬品投与後数時点で採材し分析する試験)の4段階の作業を実施し,必要があれば現行の使用基準の使用禁止期間または承認の休薬期間を延長して対応する.ただし,ポジティブリスト制度の導入までの限られた時間と予算を有効に活用するため,現行の使用基準がある動物用医薬品と残留基準(暫定基準)が新たに設定される動物用医薬品について優先的に作業を進めた.なお,これらの対応方針,検討内容及び施策への反映(使用基準の改正,承認の休薬期間の変更等)については薬事・食品衛生審議会の意見を聴いて決定している.この作業のフローチャートを図2に示した. (1)使用基準による対応 使用基準については,[1]現在動物用医薬品として製造販売承認がない医薬品の基準を削除する,[2]新たに使用基準を追加する,[3]現在の使用基準の内容を変更する,の3つの内容を含む改正をポジティブリスト制度の施行と同時に実施する(農林水産省令改正施行日は平成18年5月29日). また,従来使用基準は抗菌性物質と残留基準のある内部/外部寄生虫駆除薬について設定してきたが,ポジティブリスト制度の下ではこれら以外の薬効分類の動物用医薬品についても残留基準が設定されるため,今回の改正以降はさまざまな効能・効果の医薬品についても使用基準に収載されることになる.最近の改正案の内容については,農林水産省動物医薬品検査所のホームページ(http://www.nval.go.jp)でご覧いただきたい. (2)休薬期間による対応 暫定基準が設定される動物用医薬品には,一部の対象動物についての使用禁止期間の決定のための試験資料が十分でなかった等の理由でポジティブリスト制度の施行と同時の使用基準設定ができなかったものがある.また,暫定基準が設定されなかった動物用医薬品のうち,使用方法等から畜水産物に残留する可能性があると推定されるものについては,残留試験成績,吸収・排泄・体内分布等の試験成績,物理化学的性質,他の対象動物の試験成績,類似の性質の動物用医薬品の試験成績を広く総合的に考察し,休薬期間の設定または承認された休薬期間の変更をする.これらの場合には個々の動物用医薬品ごとの対応となるので,個々の製品に変更を記載した説明書を添付するなど獣医師及び使用者に対する情報提供に努めていきたい.不明な場合には当該製剤の製造販売業者に問い合わせいただくか,農林水産省動物用医薬品検査所のホームページでご覧いただきたい.
|
|||
| 4 農林水産省の今後の対応 (1)厚生労働省による暫定基準の見直し 残留基準は,本来その物質の毒性試験成績から得られた無影響量を安全係数で除して算出される1日摂取許容量(ADI)と残留試験成績等に基づいて算出されるものであるが,今回設定された暫定基準はそのような評価方法によって設定されたものではなく,動物用医薬品については承認申請時の残留試験の検出限界値や各国の残留基準値を根拠として,食品安全委員会による通常の評価を受けずに,暫定的に設定された値であるので,厚生労働省はポジティブリスト制度の施行後5年間を目途とし,食品安全委員会による暫定基準値の評価を受けて,必要な修正を行っていく予定としている. (2)今後の使用基準の改正,休薬期間の変更 農林水産省は,厚生労働省の暫定基準値の見直しの結果に対応した使用基準の改正や休薬期間の変更を行っていく予定である.また,ポジティブリスト制度の施行までに使用基準が設定されなかった動物用医薬品や新たに実施された残留試験成績等により休薬期間の延長が必要であると判明した動物用医薬品については,今後も引き続き使用基準の設定,休薬期間の変更を行っていく予定である. |
|||
5 診療獣医師の方々へのお願い (1)最新の使用基準及び休薬期間を正確に把握し,遵守すること. |


| 6 終 わ り に 以上,農薬等のポジティブリスト制度と動物用医薬品に関する農林水産省のその対応について述べた.この制度について,臨床獣医師の皆様が理解され,適切に対応されるよう協力いただきたい.今後もいろいろな媒体を用いて制度について引き続きお知らせしたい. |
| † 連絡責任者: | 遠藤裕子(農林水産省消費・安全局畜水産安全管理課) 〒100-8950 千代田区霞が関1-2-1 TEL 03-3502-8111(内3165) FAX 03-3502-8275 |