| |.は じ め に |
猫ひっかき病(Cat-scratch disease; CSD)がフランスで初めて臨床的に報告されてから[26]約半世紀が経過した.本症は報告された当初から猫が関与する疾病として認識されていたが,病原体が確定されないまま今日に至ったため,その研究は他の疾病に比べ遅れていたと言わざるを得ない状況にあった.1990年代の米国において,猫が感染源となってAIDS患者に発生した特殊な血管増殖性疾病から新種の細菌Bartonella
henselae(当時はRochalimaea henselae)が分離されたことが契機となって,本菌がCSDの主要な病原体であることが明らかとなった.その後,ペットブームの影響から猫が多くの家庭で飼育されるようになると,CSDの発生件数も増加し,医学領域でも本症は新興感染症として注目を集めるようになった.
Bartonella henselae が発見され10年が経過した[93].その間,種々の動物から新種のBartonella 属菌が分離され,また,数種のBartonella 属菌が人獣共通感染症あるいは新興感染症の病原体としての意義を有していることも明らかとなってきた.しかしながら,Bartonella 感染症に関する研究の歴史は他の疾病に比べ浅く,いまだ不明な点も多く残されている.
本稿では,これまでに明らかにされたBartonella 感染症の知見について整理するとともに,人および動物のBartonella 感染症の疫学についてCSDを中心として概説する. |
| ||.Bartonella 属菌の分類と自然病原巣 |
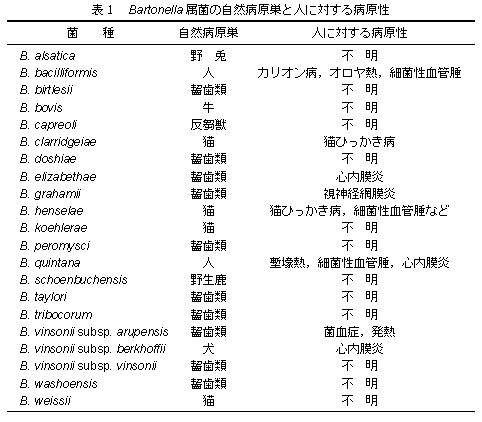
Bergy' sマニュアル第2版ではBartonella 属の菌は,Proteobactera 門,Alphaproteobacteria 綱,Rhizobiales 目,Bartonella 科,Bartonella 属に分類されている.Bartonella は一科一属の細菌で,現在,19種3亜種が知られている.いずれもほ乳類を自然病原巣とし,人に病原性を有すると考えられているものは8種(1亜種を含む)である(表1).これらのうち,B.
bacilliformis とB. quintana は人が病原巣である.B. clarridgeiae,B. elizabrthae,B. grahamii,B.
henselae,B. vinsonii subsp. berkhoffii,B. vinsonii subsp. arupensis の6菌種は家畜や野生動物を病原巣とし,人獣共通感染症の起因菌と考えられている.
齧歯類を自然病原巣とするBartonella 属菌は,B. birtlesii,B. doshiae,B. grahamii,B. peromysci,B.
taylori,B. tribicorum,B. vinsonii subsp. arupensis,B. vinsonii supsp. vinsoniiおよびB.
washoensis の9菌種が知られており,人に対してB. grahamii は視神経網膜炎を[51],B. vinsonii subsp. arupensis は敗血症,発熱などを起こすことが報告されている[91].
B. elizabethae の病原巣は現在のところ不明であるが,ペルーのラットから分離されたBartonella が本菌(F925株)に類似したクエン酸合成酵素遺伝子(gltA)を有していたこと[8],さらに,北アメリカの齧歯類から分離された株が,B.
elizabethae であったことから[32],本菌の自然病原巣は野生齧歯類ではないかと考えられている.
| 人と動物のBartonella 感染症 |
 |
B. vinsonii subsp. berkhoffiiの病原巣は,犬および犬科の動物である.本菌は心内膜炎を呈した犬から最初に分離され[11],その後,米国の政府機関で働く健康な労働犬の8.7%(162/1872)が[44],また,室外犬の3.6%(69/1920)が[73]B.
vinsonii subsp. berkhoffii 抗体陽性であることが示された.さらに,犬科の野生動物であるコヨーテ(Canis latrans)の28%からB.
vinsonii subsp. berkhoffii が分離されており[16],35.4%(308/869)が本菌の抗体陽性であった[17].
猫を自然病原巣とするBartonella はB. henselae,B. clarridgeiae,B. koehlerae の3菌種が知られている.B.
henselae はCSDの主要な病原体であるが,B. clarridgeiae も人に定型的,非定型的なCSDを起こすことが報告されている[55, 59].最近の研究から,B.
henselae はPCR法により2種類の16SrRNA型に分類されること[6, 79],PCR産物の制限酵素切断パターン[35],パルスフィールド電気泳動パターン[65, 80]などにより種々の遺伝子型に分類されることが明らかとなり,その生態も複雑化の様相を呈している.B.
koehlerae の猫からの分離は他の2菌種に比べきわめて難しく,分離報告例は一例のみである[31].B. weissii も猫から分離されているが,後述する理由から猫が本来の病原巣とは考えにくい.
反芻獣からもBartonella 属菌が分離されている.B. capreoli はフランスのノロ鹿(Capreolus capreolus)[41]およびB.
schoenbuchensis がドイツのノロ鹿[27]からそれぞれ分離されている.米国やフランスの牛からもBartonella 属菌が高率に分離されている[7, 12].肉牛から分離された株の16SrRNA遺伝子のシーケンスが猫から分離されたB.
weissii のそれと100%一致していたこと,さらに,Bartonella が分離された牛がB. weissii に対する高い抗体価を有していたことが示された[12].フランスの乳牛の血液から分離されたBartonella は,B.
bovis と命名され,B. weisii とDNAの相同性が80%あること,さらに,本菌は牛の35%から分離されたのに対し,猫からの分離例はきわめて少ないことから,B. weisii をB.
bovis とするよう提唱されている[7].これら反芻獣由来のBartonella の人に対する病原性は不明である. |
| |||.Bartonella 属菌のベクター |
多くのBartonella 属菌の伝播にベクターが関与していると考えられている(表2).
スナバエの仲間(Lutzomyia spp)はB. bacilliformis のベクターである.ペルーではスナバエ(L. verrucarum)の分布とBartonella 感染症の流行地との関連性がみられている.このスナバエはエクアドルのBartonella 感染症の流行地域ではみられないが,他の近縁種のスナバエが存在する.アカゲザルの間でマダニ(Dermacenter
andersoni)によりB. bacilliformisの感染が伝播されたことから,本菌の感染と伝播にスナバエ以外の節足動物が関与している可能性も指摘されている[69].
コロモシラミ(Pediculus humans corporis)はB. quintanaを伝播することが知られている[74].フランス[77],ロシア[78],日本[81]などのホームレスの人に寄生したシラミから本菌の遺伝子が検出されている.実験的にアタマシラミ(Pediculus
humans capitis)が本菌を伝播することが報告されているが,自然条件下でその伝播が起こっているかは不明である[69].
CSD患者は,ネコノミ(Ctenocephalides felis)が多く寄生した子猫を飼育している人で多発しており[54],また,B. henselae 保菌猫に寄生していたネコノミからも本菌が分離されたこと[33]や猫から採取したノミの33.3%(12/36)からB.
henselae のDNAが検出されていること[45]から,ネコノミがB. henselae のベクターである可能性が示唆されている.Chomelら[23]は,B. henselae 菌血症の猫から採取したノミを5匹のSPF猫に寄生させたところ,SPF猫は数週間後にすべて菌血症になったことから,B.
henselae の猫間の伝播にネコノミが関与していることを実験的に明らかにした.Maruyamaら[63]は,ノミが寄生していた猫のB. henselae 抗体保有率が寄生していない猫に比べ有意に高かったことから,ノミが本菌のベクターであることを示した.また,ノミの腸管内でB.
henselae が長期間生存すること[42]や感染猫の血液を吸血したノミの糞を他の猫に接種することで,感染が成立することも報告されている[72].猫では何らかの理由で口腔内にB. henselae が排菌されるか,あるいはノミの糞便中に排泄され猫の体表に付着し,それをグルーミングの際に歯牙や爪に付着させたり,感染ノミを口腔内に取り込んで本菌に汚染されることにより,猫間あるいは猫から人へ創傷感染するものと思われる.
現在のところ,ノミから人へのB. henselae 感染は明らかにされていないが,猫から受傷していないにもかかわらず,飼い主が自分の猫のノミを駆除した後にCSDを発症した例が,日本[95]やオーストラリア[33]で報告されている.ネコノミは広い宿主域を有することから,感染猫の血液を吸血したノミが人へ本菌を伝播する可能性も否定できない.
ダニが人へのBartonella の伝播に関与しているかについては明らかにされていないが,動物間で本菌の伝播に関わっていることが判明しつつある.米国のマダニ(Ixodes scapularis)とオランダのマダニ(Ixodes
ricinus)は,しばしばBartonella に感染していることが報告されている[15, 83].米国では,重度のダニの寄生歴を有していた犬ではB. vinsonii subsp. berkhoffii 抗体陽性率はダニの寄生が無かった犬に比べて14倍高いこと,さらに,B.
vinsonii subsp. berkhoffii 抗体陽性率とEhrlichia. canis あるいはBabesia canis の抗体陽性率に関連性がみられたことから,クリイロコイタマダニ(Rhipicephalus
sanguinaus)がB. vinsonii subsp. berkhoffiiの犬間の伝播に関与している可能性が指摘されている[73].さらに,米国の野外で捕獲されたダニ(Ixodes
pacificus)からB. bovis,B. henselae,B. quintana,B. washoensis,B. vinsonii subsp. berkhoffii の遺伝子が検出されたことから,ダニはこれらのBartonella の動物や人への伝播に重要な役割を果たしているものと考えられる[15].
B. elizabethae の伝播に関与するベクターは明らかになっていない. |
|
![]()
![]()