| 40�D�T�C�g���K���E�C���X�ɂ���]�̑w��]� |
| �k�Έ䐳�l�i��錧�j�l |
�@LWD��C�����Y�C35����C�Ӓ�E�D2000�N�H�����痣��7�`10����̎q���ˑR�̐H�~�s�U�C�_�o�Ǐ��悵40�������S�����D�{�Ǘ�́C�����̔��������S���C����C���l�B��C����^���C�k���Ȃǂ̐_�o�Ǐ��悷��3�����Ӓ�E����������1���ł���D
�@�U���ł́C����������s�ǂ̑��C���Ɉُ�݂͂��Ȃ������D
�@�g�D�w�I�ɂ́C��]�őw��ɏd�x�̔]����C�����ɊO�����w��������̍זE�w�ɂ����Ă݂�ꂽ�i�}40�j�D����ł͎��b�����זE�̐Z����O���A�זE�̑����������ŁC���ǐV���C�_�o�זE�̕ϐ��C�_�o�H���ہC�O���A���߂���ш͊ǐ��זE�Z�����F�߂�ꂽ�D������ӂ̏����Ǖǂɂ̓R�b�T�����A���CPAS�����^�z���̔��ׂ��������t�����Ă����D�܂�ɓ�����͂̐_�o�זE�ɍD����j�������̂��F�߂�ꂽ�D�j�������̂͐t���̔A�Ǐ��זE����ѝG���̉A�|���זE�ɂ��݂�ꂽ�D�R�T�C�g���K���E�C���X�iPCMV�j�R�́i�����q���������j��p�����Ɖu�g�D���w�I���F�ɂ��C�]�ł͕a�ϕ�����ю��͂̃O���A�זE�C�}�N���t�@�[�W����ѐ_�o�זE�̍זE���ŗz���������݂�ꂽ�D�t���ł͊j�������̂��܂ޏ��̍זE�����z�����������D
�@�a�������ł́C�G���C�t������є]���܂ɂ��ēT�[�R�E�C���X�����PCMV��PCR�@�����{�����Ƃ���C�S���킩��PCMV��`�q�����Y�������o���ꂽ�D�܂��C�G������G���e���E�C���X���������ꂽ�D�R�����͒��ڌu���R�̖@�ʼnA�����m�F���ꂽ�D
�@�ȏ�̐��т���C�{�Ǘ�͓T�C�g���K���E�C���X�a�Ɛf�f���ꂽ�D�q�g�ł̓T�C�g���K���E�C���X�ɂ��]��a�ς̌`��������Ă��邪�C�ł͕��Ȃ��C�������Ǘ�Ǝv��ꂽ�D |
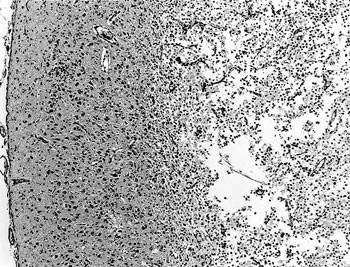
| �}40 |
�T�C�g���K���E�C���X�ɂ���]�玿�̑w��]��iHE���F�@�~50�j�D |
|
| 41�D�{�̃��X�e���A�]�� |
| �k�U�����P�i���������j�l |
�@���p�{�C�Y�C62����C���S��D���p�{800�H��2�̕������ȈՌ{�ɂŎ��{����{�{�_��ɂ����āC2000�N8��28����1�{�ɓ���2�H�������悵�C����1�H�����S�����D����ɁC9��1���ɓ���{�ɂɂ����āC1�H�Ɏ���ъ�ʕ���C1�H�ɚn����F�߁C1�H�̎��S���m�F���ꂽ�D
�@�U���ł́C��v����ɒ��ς͔F�߂��Ȃ��������C�z���}�����Œ��̉����c�f�ʂɓ��������ŔF�߂�ꂽ�D
�@�g�D�w�I�ɂ́C�����Ɍ����ȋU�D�_���̐Z���E�W�Ƒ�����ѓ���������I�ɂ݂��i�}41A�j�C��a�����ӂɂ͈͊ǐ��זE�Z������уO���A�זE�̑��B���F�߂�ꂽ�D���ǂ̕ϐ��E�C���ۑf�����C�o������ѐ_�o�זE�̕ϐ��E���݂�ꂽ�D���]�ł́C�����Ɍy�x�̉��^�a������ш͊ǐ��זE�Z���C�����Ɍy�x�̃����p������у}�N���t�@�[�W�̐Z�����F�߂�ꂽ�D���t�ł͐����Ɉ͊ǐ��זE�Z���Ɛ����Ɍy�x�̃����p������у}�N���t�@�[�W�̐Z�����F�߂�ꂽ�D�O�������F�ɂ��C��������я��]�̕a�ϕ��ɃO�����z���̏����ۂ������ώ@���ꂽ�D�܂��C�R���X�e���A�R�́i�f���J�����j��p�����Ɖu�g�D���w���F�ł́C�a�ϕ��Ɉ�v���đ����̗z���R�����Z���זE�̍זE�����Ɍ��o���ꂽ�i�}41B�j�D�̑��ł͏������U�ݐ��ɔF�߂�ꂽ�D
�@�a�������ł́C�]�C�̑�������B������Listeria monocytogenes�i�����^4b�j���������ꂽ�D
�@�ȏ�̐��т��{�Ǘ�͌{�̃��X�e���A�����ǂƐf�f���ꂽ�D�{�ɂ����郊�X�e���A�����ǂ͂킪���ŏ��̕ł���D |
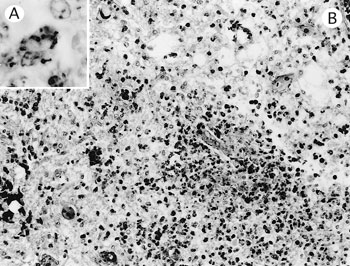
| �}41 |
A�F�U�D�_���̐Z���E�W�Ƒ��Ɠ���iHE���F�@�~200�j;B�F�Z���זE�̍זE���ɂ݂�ꂽ���X�e���A�ۍR���iSAB�@�@�~1,000�j�D |
|
| 42�D���̔畆�ɂ݂�ꂽ���������� |
| �k�����G���i�R�`���j�l |
�@���јa��C���C28�J����C�Ӓ�E�D��10�J����Ō��O���瓱���������̑̕\�Ɍy�����N������ᎂ��U�����Ă����D�畆�a�ς��d�x�ƂȂ�������2000�N9��27���Ɏ���I�ɓ������ꂽ�D
�@�U���ł́C�`����������Ɏl���ɂ����ė������ɑ傫��1�`3cm�̔畆��ᎂ��������Ă����D��ᎂ͔畆�Ɍ��ǂ��Ă���C�E�сC�o��`���C�o�����Ă����D��ᎂɍd�����͂Ȃ����ʂ͏[�����œ����F�ł������D�̕\�����p�߁i����C�������߁C���[�C�G���j�͎�債�Ă����D��������ɂ͒��ς͔F�߂��Ȃ������D
�@�g�D�w�I�ɂ́C�^��ɂ����Ď�ᇍזE�����ۊԂɐZ���E���B���C���ߏ�ƂȂ��Ă����i�}42A�j�D��ᇍזE�͗މ~�`�`�ȉ~�`��悵�C�j�͉~�`�C���^�C�W���ŁC�j���̂�1�`3����C�j���������U�����ꂽ�i�}42B�j�D�זE���͖L���ŁC���ׂȍD�_���y���I�L�V�_�[�[�z���������܂�ł����D�g���C�W���u���[���F�Ŏ�ᇍזE�Ɉْ����F�͊ώ@���ꂸ�CCD3�����CD79a�̃��m�N���[�i���R�́iDAKO�j��p����SAB�@�ʼnA���ł������D
�@�a�������ł́C�������a�E�C���X�͍R�̌�����PCR�@�ʼnA���ł������D���t�����ł́CWBC 16,000�ł������D
�@�{��́C��ᇍזE�̍זE���Ƀy���I�L�V�_�[�[�z�����������F�߂�ꂽ���Ƃ���C����������Ɛf�f���ꂽ�D |
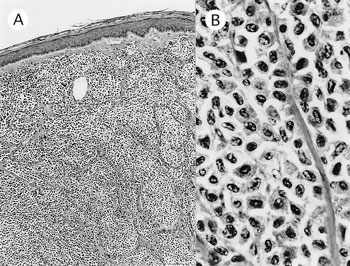
| �}42 |
A�F�畆�̎�ᇁiHE���F�@�~50�j;B�F��ᇍזE�͖L�x�őe���ȍזE���������Ă���iHE���F�@�~400�j |
|
| 43�D���̔畆����ё�l�݂ɂ݂�ꂽ�����p��i����T�זE�����p��j |
| �k�������u�i�k�C���j�l |
�@�z���X�^�C����C���C2�C�Ӓ�E�D2000�N3�����{����畆�ɋu�]���݂��C�����Ŕ畆�^�����a�Ɛf�f�����3��27���ɊӒ�E���ꂽ�D
�@�U���ł́C�����\���ɂ����Ă̔畆�ɒ��a2�`5cm�Ŋ��ʐ��l�̌��߂��������Ă����D�̕\�C�x����ѐt���t���C�哮�����̊e�����p�߂͎�債�Ă����D�C�ǂ͔�����S���ʂɔ��F���߂��C��l�ݔS���ɂ͔��F�ŝG���Ȏ�ᎂ��������C�t���͎�債�Ǝ�Ŋ��ʂ͉����F���l��悵�C�S���S�����ɂ���F�a�ς��F�߂�ꂽ�D
�@�g�D�w�I�ɂ́C�畆�ł́C�\�璼���Ɏ�ᇍזE�̐Z���E���B���������i�}43A�j�D��ᇍזE�̑����͑�^�ŁC��D������痼���F���̍זE���ƕs���Ȃ����މ~�`�̒W���Ȋj��L���C�j�����j�Z�k���������F�߂�ꂽ�i�}43B�j�D��ᇍזE�͖Ɖu�g�D���w�I��CD3�iDAKO�j�CCD2�C8�C11c�C49d�CWC1�iVMRD�j�����perforin�iANCELL�j�z���������C�P���`�����F����͂��̕��z�����w�Ɣ��f���ꂽ�D��l�݂ł͔S���ŗL�w�C�ꕔ�̔S�����g�D�Ɏ�ᇍזE�̐Z�����F�߂��C�ŗL�w�ł͌`���זE�̐Z�����Ă����D��ᇍזE�́C���̑��C�S���̐S�ؐ��ۊԁC�C�ǂ̔S���ŗL�w�C�t���Ԏ��C�x�̏��t�Ԏ��C�̕\�����p�߁C�x����ѐt���t�������p�߁C�哮���������p�߂ɐZ�����Ă����D
�@�a�������ł́C�Q�������~�����ɂ��BLV�R�̌����͉A���ł������D
�@�������a�̕��ނɂ��Ă͂߂�Ɣ畆�^�ƂȂ邪�C����T�זE�̃}�[�J�[WC1���z���ł���C�畆�a�ςɉ����đ���C�S���n�ɂ���ᇍזE�̐Z�����F�߂�ꂽ���Ƃ���C�]���̔畆�^�����a�Ƃ͕a�ς̕��z���قȂ�Ǘ�ł������D |
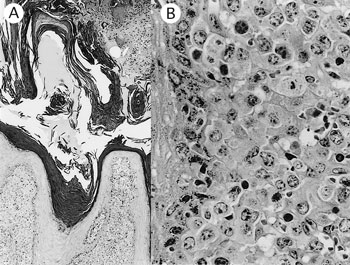
| �}43 |
A�F�畆�̎�ᇂƊp�����i�iHE���F�@�~50�j;B�F���w�ł̎�ᇍזE�̐Z���E���B�iHE���F�@�~400�j |
|
| 44�D�I�L�S���h�E�N�W����Fusarium sp.�ɂ������畆���Ɣx�����C�Ԏ��̔�������^���C�ǎx�x�� |
| �k�o�������i���m���j�l |
�@�I�L�S���h�E�N�W���C�Y�C����7�C���S��D�����قŎ��炳��Ă����Ǘ�ŁC2000�N4������荶�w�����畆�Ɏ�ᎂ����������D���N��ɂ͉E���т��[���Ɣ��т�S��ւƎ�ᎌ`�����a�����g��E�������C���̌�w�Ȃ��肪�N������2001�N1���Ɏ��S�����D����v�[���ł͊C���̒���I�Ȋ������s���Ă��Ȃ������D
�@�U���ł́C�畆�Ɍa0.5�`1.5cm�ʼn����F�̍d����ᎂ��������Ă����D�x�͑S�t���ÐԐF�ŁC�����t�̐�[����8�~6cm��̎�ᎂ����������D�Ŕ���Ă����D
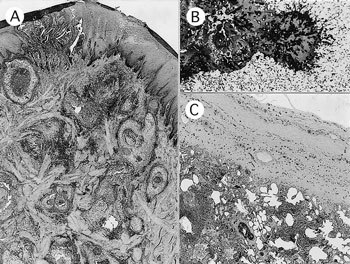
�@�g�D�w�I�ɂ́C�畆�ł͐^�炩��牺�D�[���ɂ����čזE�ޔp���Ƌێ���𒆐S�Ɏ��͂��}�N���t�@�[�W�C�A����זE�C�D��������у����p���ƌ����D�ň͂܂ꂽ�����������Ă����i�}44A�j�D�����̒��S�͕\�ݕ��őޔp�����D���C�[�ݕ��ł͋ێ����Ăł������D�܂��\�炪�^��w�ɐL�����Ă����D�ێ���PAS�����z���C�O���R�b�g���F�ō������i�}44B�j�C�RFusarium�R�́i�M�B��j�ɗz�����������D�x�͂��������ŁC�����ƊԎ��Ő��ۂ̑���������C�C�ǎx�Ɣx�E�ɂ̓O�����A�����ہ`�Z���ۂƃu�h�E���ۂ��܂ޔ���������Ƃ���זE�c�����[�����Ă����i�}44C�j�D
�@�a�������ł́C�畆���Fusarium sp�C�x����Staphylococcus aureus ��Enterobacter spp. ���������ꂽ�D
�@Fusarium ���i�ԃJ�r�j�ɂ��畆���͊��̈�����Ɖu�\�̒ቺ�ɔ����ċN����Ƃ���Ă���D�C���J�ނł͕\�ݐ��畆���̕����邪�C�[���Ɍ��߂������͂܂�Ǝv��ꂽ�D���^���C�ǎx�x���́C�x�̐��ۑ��������n�Ƃ������̂Ǝv��ꂽ�D |
| �}44 |
A�F�畆�̑��������߁iHE���F�@���[�y�g��j;B�F������Fusarium ���̋ێ���iPAS�����@�~50�j;C�F�x�����̔���Ɣx���iHE���F�@���[�y�g��j�D |
|
| 45�D�q���̑�ڍ��̍��[��������ipremature physeal closure�j�i���̃n�C�G�i�a�j |
| �k�R�{����i���茧�j�l |
�@�z���X�^�C����C�Y�C8�J����C�Ӓ�E�D250�����{�̓��Y���_�ƂŁC����1�`2�T�Ԍ�̎q��16����11���ɒE�сC�푉�C�N���s�\���̏Ǐo�āC5�������S�����D���̔_��ł͑�p�����Ƀr�^�~��AD3E�܂̌v�ʓY�����s���Ă������C�������ɂ͌v�ʂ���Ă��炸�Y���ʂ������X���ɂ������i����1���ő�VA��140��IU/���j�D�r�^�~��A�ߏ�ǂ̐f�f����C�Y�����~�ɂ���ďǏ��P���ꂽ�D���N��ɓ����Q7���ő̌^�ُ킪�����ƂȂ������߁C�ēx�a���Ӓ���s�����D�O�e�͑S�g���̔���s�ǂ������C���Ɍ㎈����s�ǂɂ��w���̉��~�������ł������D
�@�U���ł͑�ڍ����f�ʂ̍��[���͔����s���ĂŁC�������ł͏������Ă����D
�@�g�D�w�I�ɂ͑�ڍ��̐�����т��ɔ��ƂȂ��Ă���C�S�w�œ�זE���ޏk�C�������C���͐��ۏ�ł������i�}45�j�D������тɓ��L�̋���\���͈ޏk�Ȃ����������āC��тƍ������Ȃ����Ă���C���[���������������ʂ͐ΊD�����g�D�Ŕ핢����ĕ����Ă����D�`�����ꂽ�����͑a�����ɔ��ŁC�����Γ����c�����Ă݂�ꂽ�D
�@���������w�I�����ł̓r�^�~���܉ߏ蓊�^���ɂ�VA�p���~�e�[�g1,116IU/dl�CVA 651IU/dl�CVE 391IU/dl�Ƃ���������l�ł��������C���~���N��̖{�Ǘ�łُ͈�l���F�߂��Ȃ������D
�@���̏Ǘ�͎��{�C�����I�ȑ̌^�C�l�����Ɍ㎈�̔���ُ�ƕa�ς���C�}���r�^�~��A�ߏ�ǂ̌��ǂ̋��n�C�G�i�a�Ɛf�f���ꂽ�D |

| �}45 |
��g�D�͈ޏk�C��͐��ۏ�ƂȂ�C����\���������Ă���iHE���F�@�~50�j�D |
|
| 46�D�V���q���̓�ٌ`�� |
| �k�����a���i�R�����j�l |
�@�z���X�^�C����C���C0����C���S��D���_�ƂŐ��㒼��̎q�������S�����D
�@�U���ł́C��������@���ɂ����ĕ��R�ŕ@�����Z���C�l�����p�Ȃ��Ă����D��r���C�O�r���C��ڍ��̂�������������Z���ʼn����͑����C�����͔�債�Ă����D
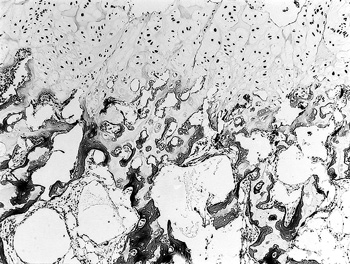
�@�g�D�w�I�ɂ́C���[��ɂ́C�G���ȍזE�œ����肳���������`������C��זE�͎�債�čזE�����S�[�X�g��ŁC��זE�w���Z���s���ɔz�Ă����i�}46�j�D�A���V�A���u���[���F�ł͓����ώ��ł͂Ȃ��C��������C�א��ۏ���������ʂ������C�g���C�W���u���[���F�ł͂����̕������ϐ���זE���тɌ`�����ꂽ�ƂƂ��Ɉْ����F���������D�����тł́C����̋���z�Ȃ��C�`�����ꂽ�����̒��S�ɂ́C��זE�������Ύc�����Ă����D�����ɂ͐ԉ苅������������̌n�̑������قƂ�ǂ݂�ꂸ�C���b�g�D�Œu������Ă����D�ߓ�ł��C��זE�̂قƂ�ǂ��ϐ����ăS�[�X�g��ƂȂ��Ă���C�⍜���l�\�����U�����ꂽ�D�̑��ł́C���S�Ö����͂���喬��ɂ����Đ��ۂ��������C�̑����B���ɋ��ʂ��Đ��O�������قƂ�ǂ݂��Ȃ������D
�@�a�������ł́C�E�C���X�C�ۂ͕������ꂸ�CBVD-MD�CIBR�C�A�f�m�E�C���X�C�A�C�m�E�C���X�C�A�J�o�l�a�̍R�̉��͂������2�{�ȉ��ł������D�ꋍ�̔D�P���̎��Ìo������уr�^�~��ADE�̒lj����^�͂Ȃ��C�����Ɠ���������^�����Ă����D
�@�̌^�ُ�ƍ��̏��������ٌ`���Ɛf�f�����D���̗�ł͍����Ɗ́C�B�ł̑������Ȃ��C�̑��̐��ۑ��������������Ƃɋ����������ꂽ�D |
| �}46 |
���[��ł͓�זE�͏��Ȃ��C��͑a�ō����т��s�K���ɗZ�����Ă���C�����ɂ͑������݂��Ȃ��iHE���F�@�~50�j�D |
|
�@�����ɁC�g�D�ʐ^�B�e�ɂ����͂��������������q���������q�������Ȏʐ^���Ȃ�тɕa���g�D�W�{�쐻�ɂ����͂��������������q�������ȕa���������ɐ[�ӂ���D
�@�{����̎��܂Ƃ߂́C�����a�������匤�E�x�V�@���i�Ǘ�ԍ�26-31�j�C�����a���������E�d�J�@���i21-25�j�C�J���M�F�i1-5�j�C�ؑ��v���q�C�a���Ӓ莺�E�v�ې��@�i16-20�j�C�a�ԕa���������E�����e�ہi11-15�j�C�R�c�@�w�i6-10�j�C�Ɖu�a���������E�S�k�p��i32-36�j�C�Ő��a���������E�������V�i42-46�j�C�O��@�C�i37-41�j�����S���čs�����D
�k�ҏW�ӔC�F�����q�������������a�����������a���������@�d�J�@���C�J���M�F�C�ؑ��v���q�l |
| ���@�Ɨ��s���@�l�_�ƋZ�p�����@�\�����q���������i��305-0856�@���Ύs�ω���3-1-5�j |
| ���@National Institute of Animal Health (3-1-5 Kannondai, Tsukuba,
Ibaraki 305-0856) |
| ���@�A���ӔC�ҁF |
�J���M�F�i�Ɨ��s���@�l�_�ƋZ�p�����@�\�����q�������������a�����������a���������j
��305-0856�@���Ύs�ω���3-1-5
TEL 0298-38-7837
FAX 0298-38-7838 |
| ���@Correspondence to : |
Nobuhiko TANIMURA (National Institute of Animal Health)
3-1-5 Kannondai, Tsukuba, Ibaraki 305-0856, Japan
TEL 0298-38-7837
FAX 0298-38-7838 |
|