| d. |
残留物の摂取から薬剤耐性菌の出現が懸念される場合,予想される腸内残留濃度が腸内に存在するE. coliや薬物群を代表するバクテリアの抗生物質に対する抵抗性に変化を及ぼさないことを示すin
vitro(糞便接種物の継代培養)あるいはin vivo(ヒトの腸内細菌が接種されたマウス,ラット,齧歯類における試験)のデータが提供されるべきである.その該当濃度からADIが算定される
|
| e. |
ヒトにおける有害作用に関連する酵素活性に変化が観察される場合,酵素活性に影響しない濃度を決定するためのin vivoあるいはin vitroの試験が行われるべきである.その該当濃度からADIが算定される. |
| |
| 具体的なリスクアセスメントの事例[13] |
上述した微生物学的ADIのスキームは,1999年に開催された第52回JECFAにおいて提案された.そのため,現時点(第54回)においては,本スキームに照合して評価された例は以下のリンコマイシン1例のみである.
リンコマイシン(第54回JECFA,2000年)
リンコマイシンは,おもにグラム陽性菌に有効なリンコサミド類に属する抗生物質である.鶏,羊,牛,山羊に飲料水や飼料に混合されて,あるいは筋注などにより投与される.
(毒性学的データ)
薬物動態試験,代謝試験,急性毒性試験,慢性毒性試験,発ガン性試験,遺伝毒性試験,聴器毒性試験(ototoxicity),免疫毒性試験,生殖毒性試験,発達毒性試験などの試験およびその結果 がADI設定のために評価された.また,同じリンコサミド類に分類され,機能的・構造的に関連するクリンダマイシン(clindamycin)が評価に用いられた.
これらの試験結果を踏まえ,毒性学的ADIは,NOEL 30mg/kg bw/day(胎児毒性試験)を根拠に,安全係数100を乗じてADI 0〜0.3mg/kg bw/dayが設定された.
(微生物学的データ)
おもな微生物学的データは以下のとおり.
|
| 1) |
ハムスターにおいて抗生物質由来の大腸炎が認められた.NOEL 0.1mg/kg bw/day
|
| 2) |
クリンダマイシンのヒトにおける臨床データ(99例,12カ月投与)で腸内細菌叢への有害な影響が認められた.NOEL 2.5mg/kg bw/day
|
| 3) |
代表的なヒトの腸内細菌に対するMICテストの結果 ,最も感受性の高い株に対してNOEC(0.2μg/ml)が設定された.
|
| 4) |
これらの試験結果を踏まえ,微生物学的ADIは,ヒトのデータを重視し,NOEL 2.5mg/kg bw/day(クリンダマイシンのヒトにおける臨床データ)を根拠に,安全係数100(10:個人差,10:クリンダマイシンよりリンコマイシンの方が腸内の生物活性が高いことによる)を乗じてADI
0〜0.03mg/kg bw/dayが設定された.なお,ADI設定のスキームを以下に示す.
|
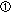 |
残留物が抗生物質的な性質を有するか.Yes
|
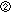 |
摂取された残留物が腸に入るか.Yes
|
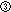 |
摂取された残留物が不可逆的に不活性な代謝物に変化するか.Yes
ただし,微生物学的に活性な残留物が残る.
|
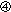 |
文献調査により,毒性学的に求められたADIが腸内細菌叢に影響を与えないことが明らかな濃度(低濃度)であるか.No
|
 |
ヒトの臨床データ(医薬品としてのヒトへの適用)あるいは,モデル試験が腸内細菌叢に影響を与えていることを示唆しているか.Yes
|
 |
ヒトの腸内細菌において最も敏感な有害作用を判断する.
ヒトの医薬品としての使用経験から腸内細菌のかく乱が示唆されていることなどから,おもな懸念は,薬剤耐性菌の出現ではなく,腸内細菌叢への影響(転移増殖阻害能のかく乱)であると考えられる
.
|
 |
転移増殖阻害能への影響が懸念される場合,計100のバクテリア株に対するMICから保守的なADIを算定する.しかしながら,適切な他の試験がある場合,その試験からADIを算定することができる.
転移増殖阻害能のかく乱がリンコマイシンの微生物的なエンドポイントと考えられる.リンコマイシンのヒトの腸内細菌叢への影響を示すデータはないものの,機能的・構造的に類似したクリンダマイシンのヒトのデータが求められており,本データをもとに微生物学的ADI
0〜0.03mg/kgを設定することができる. (ADI)
毒性学的ADIと微生物学的ADIの比較の結果,JECFAはADIとして0〜0.3mg/kg bw/dayを設定した. |