| Codexのもとにはさらに部会が設置され,残留動物薬に関連する部会は,残留動物用医薬品規格部会(CCRVDF, Codex Committee on Residues of Veterinary
Drugs in Foods)である.CCRVDFでは,JECFAの科学的な評価に基づき食品に係る国際的な規格を設定している. 1995年に世界貿易機構(WTO)が食品分野における国際貿易の基準をCodex規格とすることとしたため,特にそれ以後,Codexの国際社会における役割は重要になってきている.現在,WTO加盟国は科学的に正当な理由がある場合などを除いて,Codexにおいて国際基準が設定された場合,原則としてそれに基づいて衛生・植物検疫措置等を採ることが義務づけられている.なお,Codexの活動等の詳細については,紙面
の関係で成書等を参考にされたい[2, 11].
3.JECFAにおける残留動物薬の安全性評価
JECFAは,評価時点で収集可能な各種の情報をもとに残留動物薬の安全性評価を行い,ADIとMRLを設定している.ADIおよびMRLの定義ならびにその設定方法等は以下のとおりである.
ADI:現時点で収集可能な情報から考えて,ヒトが生涯にわたって摂取しても有害な作用を受けないと考えられる化学物質の1日当たりの最大摂取量 (mg/kg bw/day).
MRL(Maximum Residue Level,最大残留濃度):食品中に含有されても安全性の上から許容できると勧告されている動物薬の食品(畜産物)中における最大残留濃度(μ g/g).
(1)動物薬のADIの設定方法[4, 7]
ADIは,一般に毒性学的な情報をもとに設定される(毒性学的ADI).しかしながら,抗生物質などの場合には,ヒトの腸内細菌における50%細菌抑制率などの微生物学的な情報をもとにADIが設定される場合が多い(微生物学的ADI).また,アレルギーを誘発する可能性のあるペニシリンのような薬剤については,毒性および微生物学的ADIを設定せずヒトでの臨床データから,直接1日当たりのアレルギー誘発の危険性がない摂取量
を算定する場合もある.すなわち,ADIは毒性学的ADI,微生物学的ADIおよびその他の情報からのADIが比較されることによって求められている(図2参照).
以下に毒性学的ADIおよび微生物学的ADIの設定方法を示す.
なお,MRLはADIと適正に使用された場合の食品中における残留値または残留分析限界値から設定される.その詳細については,すでに他の成書等で解説されていることから,ここでは省略する[4, 8, 10]
(2)毒性学的ADIの設定方法(図3参照)
毒性学的ADI設定に必要な情報は,おおむね以下のとおりである.
a.吸収・分布・代謝・排泄に関する試験
b.単回・反復投与毒性試験
c.生殖毒性試験
d.変異原性試験
e.発ガン性試験
f.臨床報告
g.疫学データ
h.その他
上記試験等の質と量が適切であるかを判断し,適切な場合には,個々の試験ごとに無作用量 (NOEL,No Observed Effect Level)を決定する.一般的には最も低い無作用量 に安全係数が適用され,ADIが求められる.ただし,遺伝毒性発ガン物質とみなされた場合は,ADIを設定することはできない.
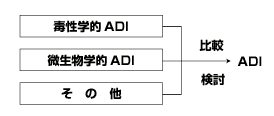 |
図2 残留動物薬のADIの設定方法
|
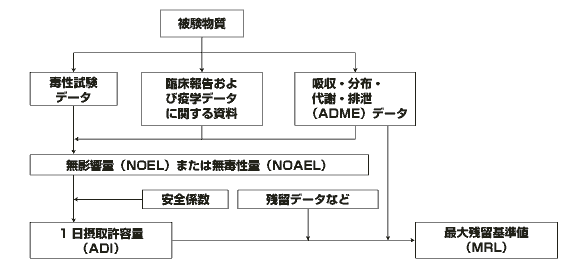 |
| 図3 JECFA におけるADI/MRL設定のための決定プロセス |
|

