総 説
犬の天疱瘡自己抗体の標的抗原
ヒトの天疱瘡 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ヒトの天疱瘡の研究はおもにPFとPVについてよく行われており,今ではそれが患者血清中に含まれるDsgに対する自己抗体に起因することが判明している.ヒトではすでにPV患者が有する細胞障害性自己抗体の標的抗原はDsg
3で,PFの標的抗原はDsg 1であることが確認されている[1, 2].ヒトのDsgをバキュロウイルスで発現させた組換え蛋白をカラムに充填して,免疫吸着カラムにPV血清を通すと,約40%の症例で蛍光抗体法によって検出される表皮細胞表面への反応が失われる[5].しかし,組換え蛋白を熱,アルカリあるいは酸で変性させると,血清の反応を吸収除去できなくなることから,ヒトの大部分の自己抗体はconformational
epitopeを認識するのではないかと考えられている[4].ヒトの天疱瘡の診断は臨床的,病理組織学的あるいは免疫組織化学的な所見に基づいて行われてきたが,現在では組換え蛋白を抗原として用いたELISA法が主流になりつつある[3].さらにNishifujiら[19]はリコンビナントDsg
1を用いたELISPOT法で,天疱瘡抗体産生B細胞数を算定し,それらがリンパ節B細胞中に多く存在することを報告している. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
犬の落葉状天疱瘡の自己抗原の検出 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
犬の天疱瘡は自己免疫性疾患と考えられているが,自己抗体が認識する標的蛋白の検出はいまだに十分ではない.しかし,犬の天疱瘡が発見されてから現在までさまざまな方法で自己抗原の検出が試みられてきた.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
天疱瘡の発生部位と自己抗原(デスモグレイン)の分布について[6] |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
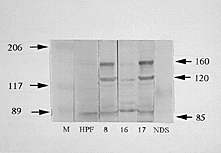
| PFの好発部位は通常鼻部,眼周囲,耳介,体幹,足底肉球など皮膚であり,粘膜に発生することは少ない.また,PVは通常,口腔粘膜,肛門,陰部など粘膜あるいは皮膚―粘膜移行部に発生し,皮膚が中心になることはまれである.このような発生部位あるいは好発部位の違いは何によって説明されうるものであろうか.この問題を皮膚あるいは粘膜中のDsgの分布から説明を試みた. 130kDaのDsg 3および160kDaのDsg 1の両方を認識するヒトPV患者血清に,それぞれヒトのリコンビナントDsg 1蛋白あるいはDsg 3蛋白を反応させてどちらの抗体を吸収させ,Dsg 1あるいはDsg 3に対する特異的抗体を作製した.この抗体を用いて,体の各部位の皮膚あるいは粘膜組織に対する蛍光抗体法およびそれらの組織抽出蛋白を用いた免疫ブロッティングを行い,各皮膚および粘膜部位におけるDsg 1とDsg 3の分布を調べた.調べた部位は鼻部,肩部,腹部,背部,耳介および足底皮膚,粘膜は口腔,食道,気管,膀胱,肛門および小腸で,これらの組織の中では通常,単層上皮である小腸あるいは膀胱粘膜にはPFの病変は認められない.その結果,PFの好発部位である鼻部,耳介および足底ではDsg 1の分布が密であった.病変があまりみられない腹部,肩部および背部ではDsg 1の分布が少なかった.一方,粘膜におけるDsg 1の分布は口腔粘膜と肛門周囲では中等度で,食道では少なく,気管,小腸および膀胱粘膜では検出できなかった(図8).PVは粘膜病変が多いが,Dsg 3の分布は口腔粘膜および肛門では中等度に存在し,気管,小腸および膀胱粘膜では検出できなかった.また,PV症状の発現頻度が低い皮膚では,Dsg 3はすべて検出限界以下であった. 以上のように天疱瘡の発生部位はヒト[26]と同様にDsgの表皮内での局在性および体の各部の皮膚あるいは粘膜における分布と密接に関連していると思われる.このことから,天疱瘡における好発部位は標的蛋白分子の分布によって説明できることになった. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ま と め |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| まだ証明は十分ではないが,現在犬の天疱瘡と診断されている症例のいくつかは,おそらく上皮細胞間接着蛋白であるDsgに対する自己抗体を有する自己免疫性疾患である.しかし,現在の診断基準に照らし合わせたPF罹患犬血清には自己抗体が証明されることが少ないため,リコンビナント犬Dsg蛋白との反応性をもとにして“真の”天疱瘡とそれ以外の原因で起こっているものを鑑別する必要があるだろう.今後はこの原因解明とともに,免疫抑制以外の新しい治療法が開発されるであろう. 本稿の執筆にあたり慶応大学医学部皮膚科西藤公司先生,岐阜大学大学院連合獣医学研究科関口麻衣子さん,同青木三代さんに感謝する. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
参 考 文 献
|